Гидроксид аммония: свойства и все характеристики
Общие сведения о гидроксида аммония
Аммиак очень хорошо растворяется в воде (при 20oС один объем воды растворяет около 700 объемов NH3). Хорошая растворимость объясняется образованием водородной связи между молекулами аммиака и воды. Поскольку молекула NH3 – лучший акцептор протона, чем H2O, то в растворе имеет место ионизация:
Появление ионов OH— создает щелочную среду раствора. Но, как это видно из значения константы основности
Kb = [NH4+]×[OH—] / [NH3×H2O] = 1,8×10-5, pKb = 4,76
реакция протекает в незначительной степени. В растворе с молярной концентрацией аммиака 1 моль/л ионизируется, например, всего лишь 0,4% молекул NH3 и H2O.
При взаимодействии ионов NH4+иOH— вновь образуются молекулы NH3 и H2O, между которыми имеет место водородная связь. Следовательно, ионное соединение NH
Из водных растворов аммиака выделяются два кристаллогидрата NH3×H2O и 2NH3×H2O, устойчивые лишь при низкой температуре. Молекулы аммиака и воды связаны в кристаллогидратах водородной связью. Так, NH3×H2O имеет структуру, в которой основой являются цепи из молекул воды, объединенных водородными связями. Цепи объединяются между собой в трехмерную решетку молекулами аммиака также посредством водородных связей:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Аммиачная вода: получение, формула, применение
Бесцветный газ с резким запахом аммиак NH3 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами H2O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
Образование иона аммония
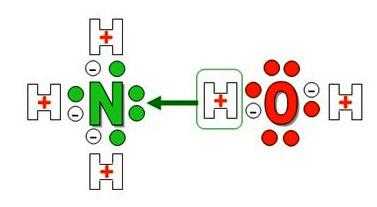 Формула аммиачной воды — NH4OH. В составе вещества присутствует катион NH4+, который образован неметаллами – азотом и водородом. Атомы N в молекуле аммиака используют для образования ковалентных полярных связей только 3 из 5 внешних электронов, а одна пара остается невостребованной. В сильно поляризованной молекуле воды протоны водорода H+ слабо связаны с кислородом, один из них становится донором свободной электронной пары азота (акцептора).
Формула аммиачной воды — NH4OH. В составе вещества присутствует катион NH4+, который образован неметаллами – азотом и водородом. Атомы N в молекуле аммиака используют для образования ковалентных полярных связей только 3 из 5 внешних электронов, а одна пара остается невостребованной. В сильно поляризованной молекуле воды протоны водорода H+ слабо связаны с кислородом, один из них становится донором свободной электронной пары азота (акцептора).Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа NH3, увеличивается количество менее вредных для живых организмов катионов NH4+
Получение гидроксида аммония. Физические свойства
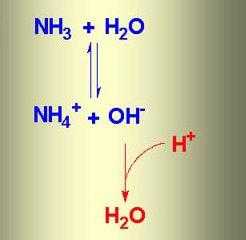
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – NH4OH, но на самом деле одновременно присутствуют ионы
NH4+, OH–, молекулы NH3 и H2O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота — покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.

Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона NH4+ бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: NH4OH + HCl = NH4Cl + H2O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2 (синий осадок).
Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.

На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом — 10-процентным раствором аммиака.
Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
fb.ru
Действие раствора аммиака (nh5oh)
Под действием раствора аммиака катионы алюминия, хрома, цинка и олова тоже образуют осадки соответствующих гидроксидов, из которых цинка гидроксид, в отличие от остальных гидроксидов этой группы, в избытке аммиака легко растворяется с образованием комплексной соли аммиаката цинка:
Zn(OH)2↓ + 4 NH4OH → [Zn(NH3)4](OH)2 + 4 H2O
бесцветный
Как уже было отмечено выше, из этой группы гидроксидных соединений хромиты обладают наиболее слабым, а арсениты и арсенаты – наиболее сильными кислотными свойствами. Следовательно, хромиты являются довольно неустойчивыми: при кипячении они легко подвергаются гидролизу с образованием хрома (III) гидроксида даже в слабощелочной среде.
при нагревании
K3[Cr(OH)6] Cr(OH)3 ↓ + 3 KOH
на холоду
Кислотные свойства [Al(OH)4]‾ несколько сильнее, чем [Cr(OН)6]3‾. Поэтому алюминаты устойчивее хромитов и при нагревании полностью гидролизуются только в присутствии аммонийных солей:
[Al(OН)4]‾ + NH4+ → Al(OH)3↓ + NH4OH (при нагревании)
Цинкаты и, в особенности, станниты, станнаты, арсенаты и арсениты более устойчивы, чем хромиты и алюминаты и из щелочных растворов осадков не образуют ни при каких условиях. Цинкаты, станниты и станнаты гидролизуются, образуя осадки гидроксидов лишь из нейтральных растворов, а арсенаты и арсениты осадка не дают, даже при нейтрализации раствора.
Следует, кроме того, отметить одну отличительную особенность хрома (III) гидроксида, а именно: свойство его соосаждать и соосаждаться вместе с гидроксидами других металлов и, в связи с этим, в присутствии некоторых катионов (главным образом, цинка, кобальта, никеля) почти полную нерастворимость его в избытке едких щелочей. Например:
1) хрома (III) гидроксид Cr(OH)3 и цинка гидроксид Zn(OH)2 порознь очень легко растворяются в разбавленной едкой щелочи; если же катионы хрома и цинка присутствуют совместно, то полученный при действии на них едкой щелочи осадок гидроксидов нерастворим даже в большом избытке осадителя.
2) ни катионы хрома, ни катионы цинка не образуют осадка при действии на них натрия ацетата. Однако если катионы Cr3+
3) осадки гидроксидов и основных ацетатных солей железа и алюминия (Al(OH)3, FeOH(CH3COO)2 ) и т.п. настолько соосаждают хрома (III) гидроксид, что последний в их присутствии также очень трудно переходит в раствор при действии избытка разбавленной едкой щелочи.
Подобное явление объясняется тем, что во всех указанных случаях хром осаждается не в форме хрома (III) гидроксида, а в виде соответствующих ему солей (кобальта хромиты Co(CrO2)2, хрома цинката Cr2(ZnO2)3 и т.п.), которые в избытке щелочей растворяются довольно трудно:
1) Cr2(SO4) 3 + 3 ZnSO4 + 12 KOH → Cr2(ZnO2)3↓ + 6 K2SO4 + 6 H2O
2) 2 CrCl3 + CoCl2 + 8 KOH → Co(CrO2)2↓ + 8 KCl + 4 H2O
3) 2 Al(OH)3 + 2 Cr(OH)3 → Al2O3↓ + Cr2O3 + 6 H2O
4) CH3COONa + H2О ↔ СH3COOH + NaOH
3 ZnCl2 + 2 CrCl3 + 12 NaOH → Cr2(ZnO2)3↓+ 12 NaCl + 6 H2O
Отмеченные выше характерные свойства некоторых амфотерных гидроксидов и их щелочных растворов нередко используются в химическом анализе для выделения и обнаружения из растворов катионов, соответствующих этим гидроксидам. Так, например:
1) если при действии на раствор, содержащий смесь катионов IV группы, разбавленной едкой щелочью, окажется, что полученный вначале осадок в избытке щелочи не растворяется, это является признаком того, что в растворе присутствуют и катионы хрома, и катионы цинка; если же осадок в избытке разбавленной щелочи растворяется – один из этих катионов в растворе отсутствует;
2) если на смесь катионов IV группы действовать избытком аммиака, то катионы хрома, алюминия и олова при этом перейдут в осадок, а мышьяк и значительная часть цинка останутся в растворе в виде AsO43‾ или AsO33‾ и, соответственно, [Zn(NH3)4]2+;
3) если при действии на раствор, содержащий катионы IV группы, избытком едкой щелочи образовавшийся вначале осадок полностью переходит в раствор, а при добавлении к этому раствору небольшого количества солей хрома осадок в избытке щелочи не растворяется – это является одним из признаков наличия в растворе катионов цинка; если же к исследуемому раствору добавить небольшое количество какой-либо соли цинка, то в этом случае нерастворимость осадка в избытке едкой щелочи будет указывать на наличие в ней хрома;
4) если из раствора требуется удалить катионы цинка, то для этого следует добавить, примерно, эквивалентное количество какой-либо соли хрома и подействовать на этот раствор избытком разбавленной едкой щелочи: при этом весь цинк практически будет соосажден с хрома гидроксидом и т.д.
ОПЫТ: К растворам солей катионов Al3+, Cr3+, Zn2+, Sn2+ (по 3-5 капель) добавляют концентрированный раствор аммиака до образования осадков соответствующих гидроксидов, из которых цинка гидроксид, в отличие от остальных, в избытке аммиака легко растворяется.
studfiles.net
Гидроксид аммония и его применение
Мало кому известно, что химическое соединение со сложной формулой Nh5OH под названием гидроксид аммония выступает в нашей обыденной жизни под многими ипостасями. Это и удобрение для картошки и свеклы, это и нашатырный спирт, это и пищевая добавка, скрывающаяся в фабричных продуктах питания под таинственным псевдонимом Е527, и даже… антифриз. Для химической промышленности раствор этого химического соединения добывают синтетическим образом. И сырьем для него служит обычный каменный уголь. В коксовых печах уголь выделяет аммиак, которым и насыщают воду в различных пропорциях.
Как насытишь гидроксид аммония – то из него и получишь. К примеру, E527, который мы так неосмотрительно поглощаем с сомнительного качества батончиками, это 25%-ный раствор аммиака. А 18%-ный раствор некоторые хозяйки и сами применяют – он известен в кулинарии как аммиачная вода. Приблизительно в этом процентном составе вещество подмешивают в корм скоту. Как удобрение аммиачную воду используют в 20,5%-ном растворе. По эффективности она не уступает удобрениям в виде порошка – нитратам и аммиакам.
В промышленности гидроксид аммония применяется в процессе производства красителей, ферросплавов, марганца. Его используют для выработки кальцинированной соды. В строительстве аммиачную воду используют для защиты арматуры от коррозии. Ее также добавляют в цемент, вследствие чего он дольше твердеет и его легко укладывать. Многие водители также имеют дело с раствором этого вещества– его используют для производства антифриза. Оно также незаменимо при выработке селитры.
В медицине гидроксид аммония нашел чуть ли не самое широкое применение. Десятипроцентным раствором выводят из обморока и стимулируют рвоту, поскольку резкий запах аммиака учащает дыхание и поднимает кровяное давление. Однако ватку с нашатырным спиртом нужно подносить к носу больного осторожно: в некоторых, хотя и единичных, случаях, он может, наоборот, вызвать остановку дыхания. Чтобы вызвать рвотный рефлекс, вещество сильно разводят водой – неразведенный нашатырь может вызвать ожоги стенок желудка и пищевода, отрицательно сказаться на печени. При укусах насекомыми, миозите и невралгии этот раствор применяют в качестве примочек, а хирурги перед операцией моют руки в теплой кипяченой воде с нашатырем. Но это вещество противопоказано при некоторых кожных заболеваниях (к примеру, экземах) и не стоит наносить его на кожу с порезами и травмами.
Родственным по звучанию гидроксиду аммония, однако, совершенно отдельным веществом является аммоний углекислый (другое название карбонат аммония). Его также широко применяют в пищевой промышленности, но уже под другим кодовым номером эмульгатора: Е 503. Естественно, производители утверждают, что эмульгатор абсолютно безвреден для здоровья. Еще эмульгатором Е 503 некоторые недобросовестные производители пива заменяют пивные дрожжи. Раньше Е503 для пряников и вафель вырабатывался из мясных отбросов, а теперь его получают путем химического синтеза. Бесцветные кристаллики аммония хозяйки применяют в качестве разрыхлителя теста. Также это соединение используется в огнетушителях и для получения производных солей аммония.
Далекий от химии человек может спутать названия гидроксид аммония и гидроксид кремния. Однако перепутать действительно можно только названия. По виду это последнее вещество выгодно отличается от извлеченного из угля эмульгатора, а по запаху – от нашатырного спирта. Его совершенно нельзя есть. Зато как приятно носить на пальце, шее или в ушах! Гидроксиды и оксиды кремния образуют довольно широкую группу минералов, близких к кварцу. Сюда входят и мерцающий матовым блеском опал, и красный сердолик, и дымчатый халцедон, и аметист или прозрачный, как слеза, горный хрусталь.
fb.ru
